Los médicos piden el fin de la pandemia de Parkinson
Parkinson’s disease is not new—descriptions of the condition can be found in ancient Chinese medical texts from 425 BC and Indian medical texts from 600 BC. There have been references to Parkinson’s symptoms in documents from Greek, Roman, and other civilizations over the past two thousand years. However, it’s assumed that the condition used to be relatively rare, and it did not have a universally recognized name until recently.
In the early 19th century, the Industrial Revolution was in full swing in Europe and the United States. The air and water in London had become heavily polluted with new chemicals and toxins, leading to the term “London fog.” Dr. James Parkinson observed six men on the streets of London who exhibited what we know today to be the classic symptoms of Parkinson’s disease: tremors, stooped posture, shuffling gait, and a tendency to fall. He described these case studies in 1817 in “An Essay on the Shaking Palsy.” By the end of the 19th century, Parkinson’s disease was widely recognized by the medical community, but the cause was still unknown. It was only in hindsight that London’s pollution provided a clue.
En los 1950 s, el farmacólogo sueco Dr. Arvid Carlsson identificó el neurotransmisor dopamina y, en experimentos de laboratorio con conejos, descubrió que la dopamina juega un papel esencial en el control del movimiento del cerebro. También descubrió que administrar levodopa (L-dopa) a los conejos, que se convierte en dopamina en el cerebro, les permitió recuperar el movimiento normal.
Humans naturally synthesize levodopa from the amino acid L-tyrosine. When L-dopa was administered as a drug to Parkinson’s patients, the effects were astounding. L-dopa is still the most effective drug for managing the symptoms of Parkinson’s disease. Unfortunately, L-dopa is not a cure.
No fue hasta 1982, cuando los médicos observaron un caso de Parkinson que ocurrió repentinamente como resultado de tomar una versión sintética de heroína, que los científicos descubrieron que una sustancia química podía matar las neuronas productoras de dopamina y causar la afección. Pronto descubrieron que los pesticidas de uso común tenían el mismo efecto.
Los pesticidas y otras toxinas son claramente una de las causas de la enfermedad de Parkinson; la prevalencia de la enfermedad de Parkinson comenzó a aumentar durante la Revolución Industrial y volvió a aumentar cuando se introdujeron los pesticidas sintéticos a mediados del siglo 20. Los países menos industrializados del mundo tienen las tasas más bajas de Parkinson, mientras que países como China que se están volviendo más industrializados y contaminados tienen las tasas más altas de aumento.
In marzo 2020, four neurologists and neuroscientists (Drs. Ray Dorsey, Todd Sherer, Michael S. Okun, and Bastiaan R. Bloem) released the book Ending Parkinson’s Disease: A Prescription for Action. The book is heavily focused on how widespread use of pesticides and other neurotoxic chemicals have made Parkinson’s disease the world’s fastest growing neurological disorder.
Approximately 0.3% of the general population, and 1% of people over age 60, have Parkinson’s disease. These percentages equate to 6.2 million people as of 2015, and The Global Burden of Disease Study estimates that there will be at least 12.9 million people with Parkinson’s globally by 2040.
The authors of Ending Parkinson’s Disease call Parkinson’s a man-made pandemic; instead of being caused by a virus or bacteria, it’s caused by “urbanization, population aging, globalization, and widespread availability of unhealthy products.” Their “Prescription for Action” has four steps:
- Prevent: Ban the use of neurotoxic chemicals and make lifestyle changes
- Advocate: Push for increased research funding
- Care: Expand and improve diagnosis and medical care
- Treat: Participate in research studies
A pesar de la abrumadora evidencia del papel de los químicos neurotóxicos artificiales en la enfermedad de Parkinson, está claro que estos químicos no son la única causa. Los autores también describen otros factores que contribuyen al Parkinson: genética, traumatismos craneoencefálicos, falta de ejercicio, dieta y disbiosis intestinal. No presentan investigaciones sobre el papel del estrés crónico, cuya evidencia está aumentando, pero la he incluido en esta publicación. Los autores escriben:
“Doscientos años después del ensayo de Parkinson, los investigadores han identificado muchas causas de Parkinson, pero aún quedan por encontrar más. Al igual que el cáncer, el Parkinson no es una enfermedad, sino una colección de muchas con diferentes factores contribuyentes ".
La comunidad científica está de acuerdo en que la enfermedad de Parkinson suele ser el resultado de una interacción compleja entre factores genéticos y ambientales; esto es lo que lo ha hecho tan difícil de definir, tratar y prevenir. Tener un factor de riesgo a menudo no es suficiente para desencadenar la afección, pero tener dos o más aumenta sustancialmente las probabilidades. Puede ser difícil pensar en el hecho de que tal variedad de factores pueden resultar en la misma patología o una similar. Pero esto es cierto para muchas afecciones crónicas, como el cáncer, la enfermedad de Alzheimer y la enfermedad de Parkinson.
The authors include an insightful quote from Parkinson’s expert Dr. William Weiner: “There is no single Parkinson disease…there never has been.”
El Dr. Weiner consideró que "la mala interpretación de la enfermedad de Parkinson puede estar obstaculizando los ensayos de investigación clínica". Propuso el uso del término "enfermedades de Parkinson" y sugirió que las diferentes versiones de la enfermedad tienen diferentes causas, síntomas, tasas de progresión y tratamientos.
In this post I’ll summarize some of the most important points from Ending Parkinson’s Disease, and discuss how genetics, toxins, head trauma, lack of exercise, diet and gut health, and stress all contribute to Parkinson’s. Where I have not linked to research, the studies and statistics are referenced and described in Ending Parkinson’s Disease. Be sure to read next week’s post on how people use exercise and stress reduction to boost dopamine, enhance the natural process of neurogenesis, reduce the motor symptoms of Parkinson’s, and in some cases eliminate motor symptoms completely.
¿Qué es la enfermedad de Parkinson?
La enfermedad de Parkinson es una afección neurológica degenerativa en la que las neuronas dopaminérgicas (productoras de dopamina) en una parte del cerebro llamada sustancia negra mueren. Cuando no hay suficiente dopamina en la vía nigroestriatal (que se muestra en rosa en el diagrama a continuación), se presentan síntomas motores. Otras partes del cerebro también sufren neurodegeneración, lo que provoca algunos de los síntomas no motores del Parkinson.
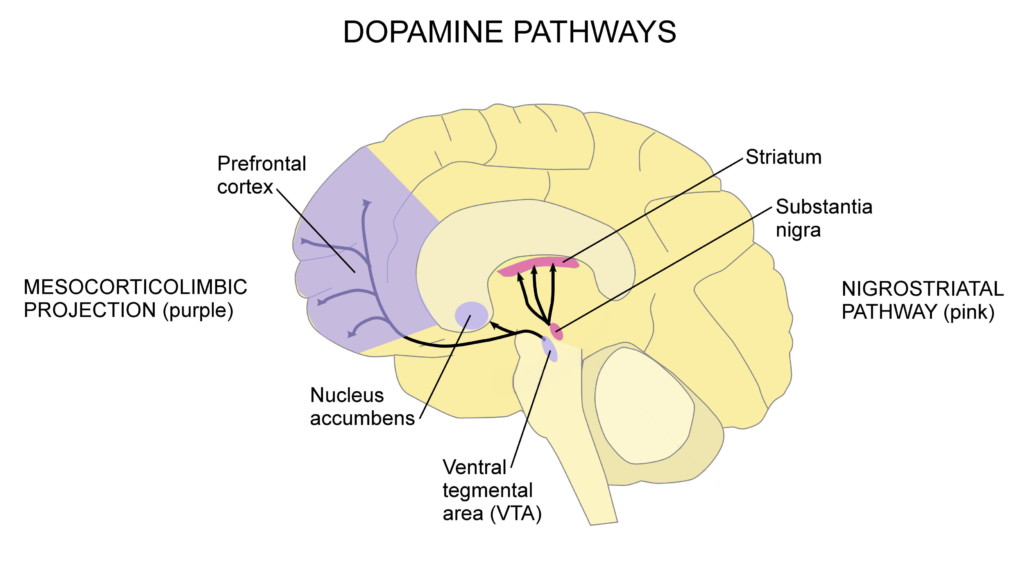
La enfermedad de Parkinson generalmente se diagnostica cuando aparecen los síntomas motores. La edad promedio de diagnóstico es la edad 60. Cuando la enfermedad de Parkinson se diagnostica después de los 50 años, se llama de aparición tardía; el diagnóstico antes de los 50 años se llama inicio temprano o inicio joven. El diagnóstico antes de los 20 años se conoce como inicio juvenil. Cuanto más joven sea una persona en la edad del diagnóstico, más probable es que la genética desempeñe un papel en su enfermedad.
La enfermedad de Parkinson de aparición tardía es la forma más común y el riesgo aumenta con la edad. Cuanto más vivimos, más tiempo hay para que se produzca la pérdida de neuronas y más posibilidades de que se desarrolle la enfermedad de Parkinson. A medida que la población mundial siga envejeciendo, veremos un aumento en las tasas de la enfermedad a menos que se realicen cambios importantes en las regulaciones y el estilo de vida de los pesticidas.
Un aspecto definitorio de la enfermedad de Parkinson son los cuerpos de Lewy, que son grupos mal plegados de la proteína alfa-sinucleína. Los cuerpos de Lewy se desarrollan en la sustancia negra y otras áreas del cerebro, así como en el sistema nervioso entérico (ENS; neuronas que controlan el tracto gastrointestinal) y causan la muerte neuronal. Los cuerpos de Lewy están presentes en casi todos los casos de enfermedad de Parkinson. Normalmente, cuando los síntomas están presentes sin cuerpos de Lewy, se conoce como parkinsonismo. El parkinsonismo puede ser el resultado de otras enfermedades neurológicas, medicamentos e infecciones.
Los síntomas pueden comenzar 20 + años antes del diagnóstico — Dr. Heiko Braak explica por qué
Los síntomas motores más comunes de la enfermedad de Parkinson incluyen temblor en reposo (temblores o temblores cuando está en reposo), rigidez o rigidez, movimiento lento (bradicinesia) o incapacidad para moverse, caminar arrastrando los pies, inestabilidad postural y deterioro del equilibrio y la coordinación. Otros síntomas motores incluyen:
- Distonía (calambres musculares dolorosos)
- Postura encorvada
- Deterioro de la destreza motora fina y la coordinación motora
- Coordinación motora gruesa deteriorada
- Balanceo de brazos disminuido
- Acatisia (tendencia a seguir moviéndose)
- Problemas del habla
- Dificultad para tragar
- Disfunción sexual
Los síntomas no motores incluyen trastornos del sueño, ansiedad, depresión, dolor, dificultades cognitivas, alucinaciones visuales y demencia.
Unfortunately, motor symptoms typically appear years after the disease process has begun—often 20 or more years after. It’s estimated that motor symptoms appear when approximately 30% to 60% of dopaminergic neurons in the substantia nigra are lost. Studies show varied results when it comes to the actual percentage of neuron loss necessary to produce motor symptoms, and it’s safe to say that the exact percentage is different from person to person. Regardless of the percentage, it is understood that when dopamine levels decrease to a certain critical threshold, tremor or other motor symptoms may be suddenly felt (I’ll discuss this in more detail in next week’s post). For many people, this is the first noticeable sign of the disease.
Una vez diagnosticados, las personas a menudo pueden reconocer los síntomas que ocurrieron años antes. Décadas antes de que comiencen los síntomas motores, las personas pueden experimentar pérdida del sentido del olfato y estreñimiento. Estos ocurren porque la enfermedad ataca la médula (una parte del tronco encefálico), el bulbo olfatorio (área del cerebro responsable del sentido del olfato) y el sistema nervioso entérico (ENS; neuronas que controlan el tracto gastrointestinal) desde el principio.
Luego, la depresión y el trastorno del comportamiento del sueño con movimientos oculares rápidos pueden ocurrir a medida que la enfermedad avanza hacia el tegmento pontino (una parte del tronco encefálico) y otras áreas. Cuando la enfermedad progresa a la sustancia negra y causa suficiente daño, se presentan síntomas motores. La demencia y las alucinaciones pueden ocurrir en las últimas etapas de la enfermedad, a medida que el daño neural se propaga al neocórtex.
In 2003, Dr. Heiko Braak along with his late wife Dr. Eva Braak and a team of researchers clearly demonstrated this progression of Parkinson’s through the nervous system in autopsy studies. That same year, Braak proposed the hypothesis that Parkinson’s disease does not begin in the central nervous system; instead, the pathogens that cause the disease enter the body through the nose and gut. This is what happens when we inhale or ingest a toxin.
Braak’s hypothesis explains why the first symptoms of the disease are loss of sense of smell and constipation. Further research has backed up his theory, showing how Lewy bodies are found in the nerves of the nose and intestines first—before they are found in the central nervous system. The pathology of Parkinson’s spreads from nerve cell to nerve cell, gradually progressing upward. Scientists believe that the vagus nerve, which connects the brain stem and gut, is the likely route by which the disease travels to the brain. Since there is “no single Parkinson disease,” this may not be how all cases progress, but substantial research suggests that it is how many cases progress.
El papel de la genética
Los investigadores estiman que entre el 10% y el 15% de las personas con enfermedad de Parkinson tienen una predisposición genética. Las mutaciones en los genes LRRK2, PARK7, PINK1, PRKN, SNCA, GBA y UCHL1, o en otros genes que aún no se han identificado, pueden aumentar el riesgo de desarrollar la enfermedad.
Algunas mutaciones genéticas afectan la forma en que las proteínas se descomponen en el sistema nervioso y, cuando las proteínas se acumulan, puede ocurrir la muerte de las neuronas. La mutación del gen SNCA hace que la alfa-sinucleína se pliegue incorrectamente y forme cuerpos de Lewy. Otras mutaciones genéticas pueden afectar la función de las mitocondrias (estructuras productoras de energía dentro de las células), lo que lleva a una acumulación de radicales libres y da como resultado la muerte de las neuronas dopaminérgicas.
La mayoría de las veces, las mutaciones genéticas por sí solas no son suficientes para causar la enfermedad de Parkinson; también deben estar presentes otros factores. Por ejemplo, cuando la mutación SNCA está presente, la exposición a niveles "seguros" de ciertos pesticidas puede provocar enfermedades. Y un estudio de más de 17,000 hermanos gemelos mostró que para la enfermedad de Parkinson de inicio tardío típico, los factores ambientales son más importantes que la genética.
El papel de los químicos neurotóxicos
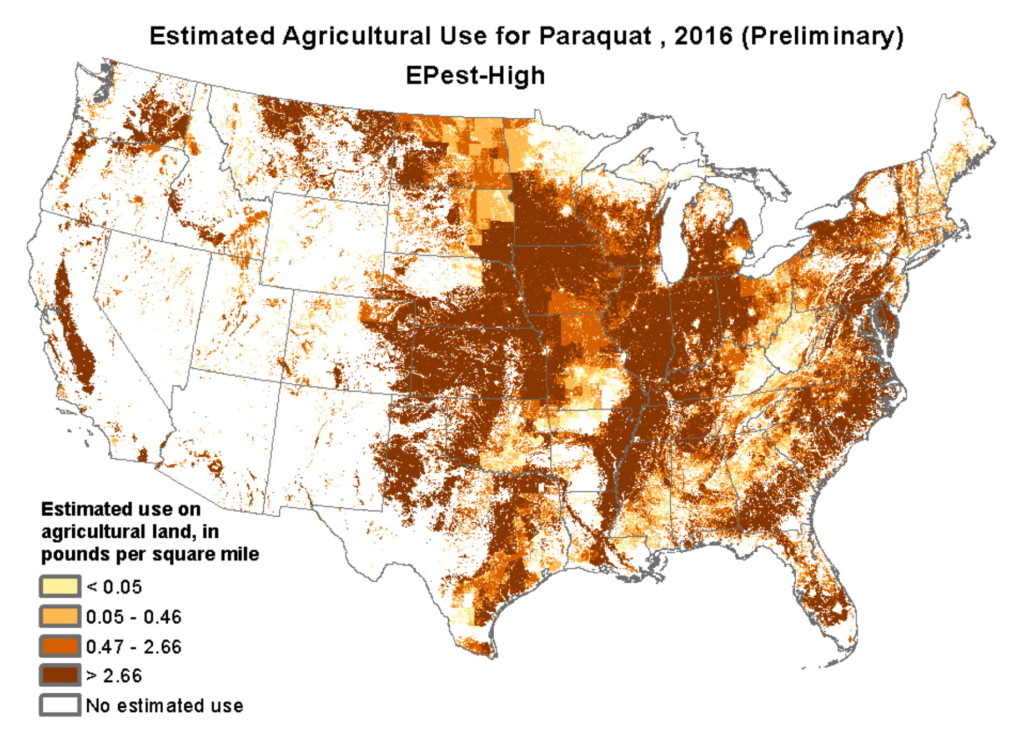
Exposure to pesticides and other neurotoxic chemicals significantly increases the risk of Parkinson’s disease. The US Environmental Protection Agency (EPA) is lagging behind when it comes to banning chemicals that have been shown to cause Parkinson’s and other diseases. For example, 32 countries, including China, have banned paraquat, a pesticide that increases the risk of Parkinson’s by 150%. The Netherlands banned paraquat, trichloroethylene (a solvent), and other pesticides linked to Parkinson’s and their rates of Parkinson’s declined sharply. The United States needs to do the same, but financial profit is clearly taking precedence over public health and safety.
En lugar de estar prohibido, el uso de paraquat en las tierras agrícolas de Estados Unidos se ha duplicado durante la última década. En estudios de laboratorio se ha demostrado que el paraquat mata las neuronas dopaminérgicas y también puede causar ceguera y hemorragia interna. Tragar una cucharadita es fatal y, debido a que está tan fácilmente disponible, la gente lo usa para suicidarse. En agricultura, el paraquat se utiliza principalmente en el cultivo de maíz, soja, trigo, algodón y uvas. El siguiente mapa muestra el uso estimado de paraquat en los EE. UU.
El uso de paraquat y otros pesticidas es la razón por la que las áreas agrícolas tienen las tasas más altas de enfermedad de Parkinson. Los agricultores tienen un 170% más de riesgo que los no agricultores de desarrollar Parkinson, y cuanto más tiempo están expuestos a los pesticidas, mayor es su riesgo. Y simplemente vivir en áreas agrícolas aumenta el riesgo de Parkinson porque el aire, el agua subterránea y el agua de pozo pueden estar contaminados con pesticidas tóxicos.
El solvente industrial tricloroetileno (TCE) también contribuye al Parkinson, así como al cáncer. Las personas expuestas al TCE en el trabajo tienen seis veces más probabilidades de desarrollar Parkinson. Hasta el 1977, el TCE se usaba como anestésico quirúrgico y, en la actualidad, todavía se usa para desengrasar metal, en la limpieza en seco y en productos domésticos como quitapinturas, quitamanchas, pegamento, limpiadores de alfombras y limpiadores de armas. Aunque se sabe que el TCE es tóxico desde los 1930 s, Estados Unidos usa alrededor de 250 millones de libras de la sustancia química cada año.
En experimentos con ratas, el TCE mata las neuronas dopaminérgicas de la sustancia negra. Un estudio encontró que el 68% de los trabajadores de una pequeña planta industrial en Kentucky tenían síntomas de Parkinson, y los que tenían la mayor exposición al TCE tenían más probabilidades de tener síntomas. El TCE puede inhalarse a través del aire contaminado, ingerirse a través del agua contaminada y absorberse a través de la piel. La EPA ha declarado que el TCE es "cancerígeno para los seres humanos por todas las vías de exposición" y que la exposición crónica es dañina para el cerebro y el sistema nervioso.
Frighteningly, up to 30% of the US drinking water supply is contaminated with TCE. Almost half of Superfund sites (designated toxic waste dumping sites) are contaminated with TCE, and local residents have higher rates of Parkinson’s disease and cancer.
También hay otros productos químicos relacionados con la enfermedad de Parkinson, incluido el Agente Naranja, un herbicida utilizado en la Guerra de Vietnam para matar la vegetación de modo que los aviones de combate pudieran ver al enemigo en el suelo. El percloroetileno (PCE) solvente de limpieza en seco, el insecticida DDT y el pesticida heptacloro son otros. Es posible que aún haya más que no se hayan identificado.
El uso de sustancias químicas tóxicas en la agricultura, la industria y ciertos productos es una de las razones por las que se diagnostica Parkinson a los hombres con un 40% más de frecuencia que a las mujeres. En EE. UU., El 75% de los agricultores son hombres, junto con el 80% de los trabajadores del metal y el plástico, el 90% de los trabajadores químicos, el 91% de los pintores, el 96% de los soldadores y el 97% de trabajadores de control de plagas.
Pesticides and other toxic chemicals kill dopaminergic neurons in a number of ways. They can damage the cytoskeleton, mitochondra, or myelin sheath (protective coating); cause oxidative stress or an overload of calcium; interfere with neurotransmission; or inhibit ALDH enzymes that detoxify the dopamine metabolite DOPAL.
While exposure to certain toxic chemicals increases the risk of developing Parkinson’s, exposure alone usually does not mean that a person will definitely get the disease. Just as at least 75% of heavy smokers will not get lung cancer, most people who are exposed to pesticides and other neurotoxic chemicals will not get Parkinson’s. It’s when pesticide exposure and other risk factors, like genetics and the lifestyle factors I’ll describe next, come together that risk increases dramatically.
El papel del traumatismo craneoencefálico
In recent years, the long term negative effects of repetitive head injuries, like those suffered by professional football players, has become widely recognized. Football players are more likely to suffer from Alzheimer’s disease, amyotrophic lateral sclerosis (ALS; Lou Gehrig’s disease), chronic traumatic encephalopathy (CTE), and Parkinson’s disease. In a 2017 study of 111 former NFL players, two-thirds of them had parkinsonian symptoms including tremor, slow movement, difficulty walking, and a tendency to fall.
La lesión cerebral traumática también es común entre los veteranos militares y atletas como boxeadores y jugadores de hockey sobre hielo, fútbol y lacrosse. Una sola lesión en la cabeza que resulta en la pérdida del conocimiento triplica el riesgo de enfermedad de Parkinson y las lesiones repetidas aumentan aún más el riesgo.
El traumatismo craneoencefálico puede hacer que las proteínas se agrupen, formando los cuerpos de Lewy del Parkinson y las placas amiloides del Alzheimer. Estos grupos de proteínas pueden hacer que las membranas celulares exploten y provoquen la muerte de las neuronas. Los científicos sugieren que se necesita más investigación para investigar si la forma de la enfermedad de Parkinson relacionada con el traumatismo craneoencefálico es la misma que está presente en personas que no tienen antecedentes de traumatismo craneoencefálico.
El papel de la falta de ejercicio
Given that movement is affected in Parkinson’s disease, it makes sense that regular exercise would help to prevent it as well as slow the progression. In a study of more than 7,300 male veterans, those with the lowest level of physical fitness had a 316% higher risk of developing Parkinson’s than those with the highest level of physical fitness.
Al igual que otras investigaciones que involucran genética, pesticidas y lesiones en la cabeza, este estudio encontró un aumento significativo en el riesgo de desarrollar Parkinson cuando estaban involucrados múltiples factores de riesgo. Los investigadores observaron la edad, el estado físico y el tabaquismo (que sorprendentemente disminuye el riesgo). Descubrieron que las personas con dos de los factores de riesgo tenían 3.7 veces más probabilidades de desarrollar Parkinson, y las personas con los tres factores de riesgo tenían 7.8 veces más probabilidades de desarrollarla.
Reduced physical activity is likely an early symptom of Parkinson’s disease; as movement becomes more difficult, people are less likely to move. Neuroscientists at the University of Texas in Austin did an interesting study to explore whether or not a reduction in physical activity also speeds up the degeneration of dopaminergic neurons. By restricting the movement of rats, they were able to show that the restriction of movement led to severe and chronic loss of dopaminergic neurons and impaired motor function. Neurons that aren’t used tend to wither away and die—this is called neural pruning. When it comes to movement, the principle of “use it or lose it” applies not only to our muscles, but to the health of our brain as well.
On the flip side, when we use certain parts of our brain a lot, it stimulates neuroplasticity and neurogenesis in those areas. And exercise stimulates neuroplasticity and neurogenesis throughout the brain by triggering the release of neurotrophic factors, which encourage synaptic plasticity, promote the initial growth and development of neurons, support neuronal survival, and even regrow damaged neurons. Not only does regular exercise help to prevent Parkinson’s, but it also improves motor symptoms and slows progression of the disease. Research shows how exercise prevents the loss of, protects, and actually restores dopaminergic neurons in Parkinson’s disease; I’ll discuss this in detail in next week’s post.
El papel de la dieta y la disbiosis intestinal
Hay varias formas en las que la dieta y la salud intestinal contribuyen a la enfermedad de Parkinson. Comenzaré con algunas de las pruebas abrumadoras de los beneficios de una dieta basada en plantas y los efectos nocivos de una dieta rica en proteínas animales.
A 2007 study of 130,000 people found that a Mediterranean-style diet (high in fruit, vegetables, and fish) was associated with a 22% reduced risk of Parkinson’s when compared with the Western-style diet (high in red meat, processed and fried food, refined grains, sugar, and high-fat dairy products). The authors of Ending Parkinson’s Disease suggest that one way a Mediterranean-style diet may be protective is that it’s high in antioxidants, which may reduce the development of Lewy bodies. Antioxidants also prevent damage to mitochondria, which are damaged in Parkinson’s disease.
Along those same lines, research shows that high consumption of dairy products is associated with an 80% increased risk of Parkinson’s in men and a 30% increased risk in women.
And in 2011, a study of Parkinson’s patients showed significant improvement of motor symptoms after just four weeks on a plant-based diet, when compared to a control group on an omnivorous diet. The explanation for the quick results may be explained by the connection between animal protein and levodopa.
A fascinating study showed how consumption of animal protein elevates levels of large neutral amino acids (LNAAs), which compete with levodopa for transport across the blood-brain barrier. On regular and high-protein diets, patients had parkinsonian motor symptoms despite having elevated levels of levodopa in their blood from medication. When patients were put on a low-protein diet, their LNAA levels dropped, and they were relieved of their motor symptoms.
Other research shows that levodopa levels and motor symptoms are both improved on a high-fiber diet. If you have three minutes, watch this video by Dr. Michael Greger about diet and Parkinson’s disease.
En relación con la dieta y otros factores, la disbiosis intestinal suele estar presente en la enfermedad de Parkinson. La disbiosis intestinal es un desequilibrio en el microbioma intestinal, la colección de microorganismos, bacterias, virus, protozoos y hongos en el tracto digestivo.
Gut dysbiosis is associated with many health issues, from neurodegenerative diseases to digestive problems, autoimmune conditions, allergies, anxiety and depression, skin conditions, obesity, and diabetes. A thorough 2019 review discusses the role of gut dysbiosis, inflammation, and leaky gut in Parkinson’s disease, and the potential role of probiotics and fecal transplantation in treatment.
A 2016 study showed that Parkinson’s symptoms are actually transmissible through fecal matter. Researchers gave mice fecal material from healthy human subjects, and their motor function was unchanged. But when the mice were given fecal material from people with Parkinson’s, their motor function worsened. Researchers suggest the possibility that fecal transplants may at some point be used to treat Parkinson’s disease.
Si bien los trasplantes fecales se están volviendo más comunes, y con razón, es posible que no siempre sean necesarios. Consumir una dieta de alimentos integrales a base de plantas, junto con prebióticos y probióticos, así como evitar los antibióticos, puede contribuir en gran medida a equilibrar las bacterias intestinales. El estrés, la falta de ejercicio y la falta de sueño también tienen efectos negativos sobre el microbioma intestinal.
Also related to diet and other factors, constipation is a very common early symptom of Parkinson’s. Men with constipation are 2.7 times more likely to develop Parkinson’s than men without. As I mentioned earlier, it’s believed that constipation occurs early on in the disease process because of the development of Lewy bodies in the enteric nervous system. It has also been suggested that constipation can contribute to gut dysbiosis because food stays in the digestive tract longer than it should. Whether or not you have Parkinson’s, the simplest ways to get things moving are consuming lots of fruit, vegetables, whole grains, and legumes; staying hydrated; and exercising regularly.
El papel del estrés crónico
El estrés crónico aumenta el riesgo de prácticamente todas las enfermedades crónicas, incluido el cáncer, las enfermedades cardíacas, las enfermedades autoinmunes y las enfermedades neurodegenerativas. El estrés juega un papel en el Parkinson de tres maneras:
1. La depresión es un síntoma temprano de la enfermedad de Parkinson y los investigadores sugieren que el estrés crónico que precede al inicio de los síntomas motores también puede ser un síntoma temprano.
2. Tener la enfermedad de Parkinson es muy estresante, ya que limita la función y tiene un mal pronóstico.
3. El estrés crónico contribuye a la aparición y empeoramiento de la enfermedad de Parkinson al aumentar la neuroinflamación y la neurodegeneración.
The third way is becoming more widely researched, as stress is finally being recognized as a risk factor for Parkinson’s. A 2017 study found that mice subjected to chronic stress experience loss of dopaminergic neurons in the substantia nigra—the same neurons lost in humans with Parkinson’s. And a 2014 study found that the inflammatory response in stressed rats led to a higher rate of death of dopaminergic neurons in the substantia nigra. This confirmed previous research showing that stress and elevated glucocorticoid levels lead to death of these dopaminergic neurons.
The stress response is regulated by the hypothalamic-pituitary-adrenal axis (HPA axis), the functional connection between the hypothalamus, pituitary gland, and adrenal glands. When we perceive stress, our hypothalamus releases corticotropin-releasing hormone (CRH), which in turn stimulates our pituitary gland to release adrenocorticotrophic hormone (ACTH). ACTH then stimulates our adrenal cortex to release cortisol and other corticoid hormones, which act on nearly every tissue in our body. The HPA axis is the mechanism by which stress and emotions affect our health. Chronic stress can cause dysregulation of the neuroendocrine and immune systems, leading to neuroinflammation, oxidative stress, and loss of dopaminergic neurons.
A study of 330 people showed the link between stress and risk of Parkinson’s; risk increased significantly with the number of stressful life events that people had experienced. A population-based study of over 2.5 million residents of Sweden found that job-related stress was associated with an increased risk of Parkinson’s disease. And stress-related personality traits, like being anxious, pessimistic, and neurotic, are associated with an increased risk of Parkinson’s.
Stress level also predicts worse disease progression. Acute stress worsens motor symptoms of Parkinson’s, including bradykinesia, freezing, and tremor. In a study of 4,155 Parkinson’s patients, stress predicted mortality and worsening mobility.
Avanzando hacia la mejora y la recuperación
Si bien no existe una cura farmacéutica o quirúrgica para la enfermedad de Parkinson, hay esperanza. Los científicos son optimistas acerca de los enfoques de tratamiento no invasivos que estimulan la neurogénesis y movilizan las células madre neurales endógenas, las que se producen naturalmente en el cerebro, para sobrevivir, migrar y diferenciarse en neuronas dopaminérgicas en la sustancia negra. Pero no tiene que esperar a que se aprueben estos tratamientos.
Los investigadores están de acuerdo en que el ejercicio, especialmente el ejercicio vigoroso, debe prescribirse a los pacientes de Parkinson como un componente del tratamiento. Señalan que actualmente no existe un tratamiento farmacológico que pueda modificar o retardar la enfermedad o proteger las neuronas dopaminérgicas como lo hace el ejercicio. Para los pacientes de Parkinson, el ejercicio hace lo que los medicamentos no pueden.
Most exciting of all, there are Parkinson’s patients who report significantly improving their motor symptoms and in some cases, eliminating them completely. For most of them, some form of mindfulness or stress reduction played a large role in their recovery. I’ll tell their stories, discuss neurogenesis as it applies to Parkinson’s, and explain how exercise and stress reduction can heal the damage done to the brain by Parkinson’s disease in next week’s post.
Lectura recomendada:
The Pain Relief Secret: How to Retrain Your Nervous System, Heal Your Body, and Overcome Chronic Pain by Sarah Warren, CSE
Somatics: Reawakening the Mind’s Control of Movement, Flexibility and Health by Thomas Hanna