Les médecins demandent la fin de la pandémie de Parkinson
Parkinson’s disease is not new—descriptions of the condition can be found in ancient Chinese medical texts from 425 BC and Indian medical texts from 600 BC. There have been references to Parkinson’s symptoms in documents from Greek, Roman, and other civilizations over the past two thousand years. However, it’s assumed that the condition used to be relatively rare, and it did not have a universally recognized name until recently.
In the early 19th century, the Industrial Revolution was in full swing in Europe and the United States. The air and water in London had become heavily polluted with new chemicals and toxins, leading to the term “London fog.” Dr. James Parkinson observed six men on the streets of London who exhibited what we know today to be the classic symptoms of Parkinson’s disease: tremors, stooped posture, shuffling gait, and a tendency to fall. He described these case studies in 1817 in “An Essay on the Shaking Palsy.” By the end of the 19th century, Parkinson’s disease was widely recognized by the medical community, but the cause was still unknown. It was only in hindsight that London’s pollution provided a clue.
Dans les années 1950, le pharmacologue suédois, le Dr Arvid Carlsson, a identifié le neurotransmetteur dopamine. Lors d'expériences en laboratoire sur des lapins, il a découvert que la dopamine joue un rôle essentiel dans le contrôle des mouvements par le cerveau. Il a également découvert que donner aux lapins de la lévodopa (L-dopa), qui est convertie en dopamine dans le cerveau, leur permettait de retrouver un mouvement normal.
Humans naturally synthesize levodopa from the amino acid L-tyrosine. When L-dopa was administered as a drug to Parkinson’s patients, the effects were astounding. L-dopa is still the most effective drug for managing the symptoms of Parkinson’s disease. Unfortunately, L-dopa is not a cure.
Ce n'est que 1982, lorsque les médecins ont observé un cas de maladie de Parkinson survenu soudainement à la suite de la prise d'une version synthétique d'héroïne, que les scientifiques ont découvert qu'un produit chimique pouvait tuer les neurones producteurs de dopamine et provoquer la maladie. Bientôt, ils ont découvert que les pesticides couramment utilisés avaient le même effet.
Les pesticides et autres toxines sont clairement l'une des causes de la maladie de Parkinson; la prévalence de la maladie de Parkinson a commencé à augmenter au cours de la révolution industrielle, et a de nouveau augmenté lorsque les pesticides synthétiques ont été introduits au milieu du20e siècle. Les pays les moins industrialisés du monde ont les taux les plus bas de maladie de Parkinson, tandis que des pays comme la Chine qui deviennent rapidement plus industrialisés et pollués ont les taux d'augmentation les plus élevés.
In mars 2020, four neurologists and neuroscientists (Drs. Ray Dorsey, Todd Sherer, Michael S. Okun, and Bastiaan R. Bloem) released the book Ending Parkinson’s Disease: A Prescription for Action. The book is heavily focused on how widespread use of pesticides and other neurotoxic chemicals have made Parkinson’s disease the world’s fastest growing neurological disorder.
Approximately 0.3% of the general population, and 1% of people over age 60, have Parkinson’s disease. These percentages equate to 6.2 million people as of 2015, and The Global Burden of Disease Study estimates that there will be at least 12.9 million people with Parkinson’s globally by 2040.
The authors of Ending Parkinson’s Disease call Parkinson’s a man-made pandemic; instead of being caused by a virus or bacteria, it’s caused by “urbanization, population aging, globalization, and widespread availability of unhealthy products.” Their “Prescription for Action” has four steps:
- Prevent: Ban the use of neurotoxic chemicals and make lifestyle changes
- Advocate: Push for increased research funding
- Care: Expand and improve diagnosis and medical care
- Treat: Participate in research studies
Malgré les preuves accablantes du rôle des produits chimiques neurotoxiques artificiels dans la maladie de Parkinson, il est clair que ces produits chimiques ne sont pas la seule cause. Les auteurs décrivent également d'autres facteurs qui contribuent à la maladie de Parkinson : la génétique, les traumatismes crâniens, le manque d'exercice, l'alimentation et la dysbiose intestinale. Ils ne présentent pas de recherche sur le rôle du stress chronique, dont les preuves s'accumulent, mais je l'ai inclus dans cet article. Les auteurs écrivent :
« Deux cents ans après l'essai sur la maladie de Parkinson, les chercheurs ont identifié de nombreuses causes de la maladie de Parkinson, mais d'autres restent à découvrir. Comme le cancer, la maladie de Parkinson n'est pas une maladie, mais plutôt un ensemble de plusieurs avec différents facteurs contributifs.
Il est largement admis dans la communauté scientifique que la maladie de Parkinson est le plus souvent le résultat d'une interaction complexe entre des facteurs génétiques et environnementaux - c'est ce qui la rend si difficile à définir, à traiter et à prévenir. Avoir un facteur de risque n'est souvent pas suffisant pour déclencher la maladie, mais en avoir deux ou plus augmente considérablement les chances. Il peut être difficile de comprendre qu'une telle variété de facteurs peut tous entraîner la même pathologie ou une pathologie similaire. Mais cela est vrai pour de nombreuses maladies chroniques, notamment le cancer, la maladie d'Alzheimer et la maladie de Parkinson.
The authors include an insightful quote from Parkinson’s expert Dr. William Weiner: “There is no single Parkinson disease…there never has been.”
Le Dr Weiner a estimé que "l'incompréhension de la maladie de Parkinson peut entraver les essais de recherche clinique". Il a proposé l'utilisation du terme « maladies de Parkinson » et a suggéré que différentes versions de la maladie ont des causes, des symptômes, des taux de progression et des traitements différents.
In this post I’ll summarize some of the most important points from Ending Parkinson’s Disease, and discuss how genetics, toxins, head trauma, lack of exercise, diet and gut health, and stress all contribute to Parkinson’s. Where I have not linked to research, the studies and statistics are referenced and described in Ending Parkinson’s Disease. Be sure to read next week’s post on how people use exercise and stress reduction to boost dopamine, enhance the natural process of neurogenesis, reduce the motor symptoms of Parkinson’s, and in some cases eliminate motor symptoms completely.
Qu'est-ce que la maladie de Parkinson ?
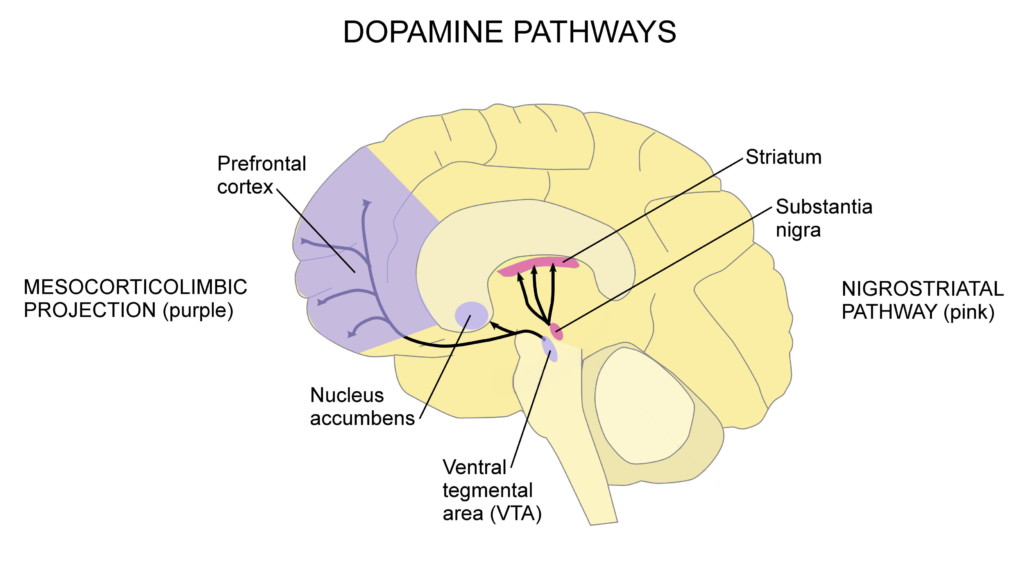
La maladie de Parkinson est une maladie neurologique dégénérative dans laquelle les neurones dopaminergiques (producteurs de dopamine) dans une partie du cerveau appelée substantia nigra meurent. Lorsqu'il n'y a pas assez de dopamine dans la voie nigro-striée (indiquée en rose dans le schéma ci-dessous), des symptômes moteurs apparaissent. D'autres parties du cerveau souffrent également de neurodégénérescence, provoquant certains des symptômes non moteurs de la maladie de Parkinson.
La maladie de Parkinson est généralement diagnostiquée lorsque des symptômes moteurs apparaissent. L'âge moyen du diagnostic est de 60. Lorsque la maladie de Parkinson est diagnostiquée après l'âge 50, on parle d'apparition tardive ; le diagnostic avant l'âge 50 est appelé début précoce ou début jeune. Le diagnostic avant l'âge 20 est appelé apparition juvénile. Plus une personne est jeune à l'âge du diagnostic, plus il est probable que la génétique joue un rôle dans sa maladie.
La forme tardive de la maladie de Parkinson est la forme la plus courante et le risque augmente avec l'âge. Plus nous vivons longtemps, plus il y a de temps pour que la perte de neurones se produise, et plus il y a de chances que la maladie de Parkinson se développe. Alors que la population mondiale continue de vieillir, nous verrons des taux croissants de la maladie à moins que des changements majeurs ne soient apportés à la réglementation sur les pesticides et au mode de vie.
Un aspect déterminant de la maladie de Parkinson est les corps de Lewy, qui sont des amas mal repliés de la protéine alpha-synucléine. Les corps de Lewy se développent dans la substantia nigra et d'autres régions du cerveau, ainsi que dans le système nerveux entérique (ENS ; neurones qui contrôlent le tractus gastro-intestinal), et provoquent la mort des neurones. Les corps de Lewy sont présents dans presque tous les cas de maladie de Parkinson. Généralement, lorsque les symptômes sont présents sans corps de Lewy, on parle de parkinsonisme. Le parkinsonisme peut être le résultat d'autres maladies neurologiques, de médicaments et d'infections.
Les symptômes peuvent commencer 20+ ans avant le diagnostic—Dr. Heiko Braak explique pourquoi
Les symptômes moteurs les plus courants de la maladie de Parkinson comprennent les tremblements au repos (tremblements ou tremblements au repos), la rigidité ou la raideur, les mouvements lents (bradykinésie) ou l'incapacité de bouger, une démarche traînante, une instabilité posturale et une altération de l'équilibre et de la coordination. Les autres symptômes moteurs comprennent :
- Dystonie (crampes musculaires douloureuses)
- Posture voûtée
- Dextérité motrice fine et coordination motrice altérées
- Coordination motrice globale altérée
- Diminution du balancement des bras
- Acathisie (tendance à continuer à bouger)
- Problèmes d'élocution
- Difficulté à avaler
- Dysfonction sexuelle
Les symptômes non moteurs comprennent les troubles du sommeil, l'anxiété, la dépression, la douleur, les difficultés cognitives, les hallucinations visuelles et la démence.
Unfortunately, motor symptoms typically appear years after the disease process has begun—often 20 or more years after. It’s estimated that motor symptoms appear when approximately 30% to 60% of dopaminergic neurons in the substantia nigra are lost. Studies show varied results when it comes to the actual percentage of neuron loss necessary to produce motor symptoms, and it’s safe to say that the exact percentage is different from person to person. Regardless of the percentage, it is understood that when dopamine levels decrease to a certain critical threshold, tremor or other motor symptoms may be suddenly felt (I’ll discuss this in more detail in next week’s post). For many people, this is the first noticeable sign of the disease.
Une fois diagnostiquées, les personnes sont souvent capables de reconnaître les symptômes qui se sont produits des années plus tôt. Des décennies avant le début des symptômes moteurs, les personnes peuvent ressentir une perte de l'odorat et de la constipation. Ceux-ci se produisent parce que la maladie attaque la moelle (une partie du tronc cérébral), le bulbe olfactif (région du cerveau responsable de l'odorat) et le système nerveux entérique (ENS ; neurones qui contrôlent le tractus gastro-intestinal) dès le début.
Ensuite, une dépression et un trouble du comportement du sommeil à mouvements oculaires rapides peuvent survenir à mesure que la maladie progresse vers le tegmentum pontique (une partie du tronc cérébral) et d'autres zones. Lorsque la maladie progresse vers la substantia nigra et cause des dommages suffisants, des symptômes moteurs apparaissent. La démence et les hallucinations peuvent survenir aux derniers stades de la maladie, à mesure que les lésions neurales se propagent au néocortex.
In 2003, Dr. Heiko Braak along with his late wife Dr. Eva Braak and a team of researchers clearly demonstrated this progression of Parkinson’s through the nervous system in autopsy studies. That same year, Braak proposed the hypothesis that Parkinson’s disease does not begin in the central nervous system; instead, the pathogens that cause the disease enter the body through the nose and gut. This is what happens when we inhale or ingest a toxin.
Braak’s hypothesis explains why the first symptoms of the disease are loss of sense of smell and constipation. Further research has backed up his theory, showing how Lewy bodies are found in the nerves of the nose and intestines first—before they are found in the central nervous system. The pathology of Parkinson’s spreads from nerve cell to nerve cell, gradually progressing upward. Scientists believe that the vagus nerve, which connects the brain stem and gut, is the likely route by which the disease travels to the brain. Since there is “no single Parkinson disease,” this may not be how all cases progress, but substantial research suggests that it is how many cases progress.
Le rôle de la génétique
Les chercheurs estiment qu'entre 10 % et 15 % des personnes atteintes de la maladie de Parkinson ont une prédisposition génétique. Des mutations dans les gènes LRRK2, PARK7, PINK1, PRKN, SNCA, GBA et UCHL1, ou dans d'autres gènes qui n'ont pas encore été identifiés, peuvent augmenter le risque de développer la maladie.
Certaines mutations génétiques affectent la façon dont les protéines sont décomposées dans le système nerveux, et lorsque les protéines s'accumulent, la mort des neurones peut se produire. La mutation du gène SNCA provoque le mauvais repliement de l'alpha-synucléine et la formation de corps de Lewy. D'autres mutations génétiques peuvent affecter la fonction des mitochondries (structures productrices d'énergie au sein des cellules), entraînant une accumulation de radicaux libres et entraînant la mort des neurones dopaminergiques.
La plupart du temps, les mutations génétiques seules ne suffisent pas à provoquer la maladie de Parkinson - d'autres facteurs doivent également être présents. Par exemple, lorsque la mutation SNCA est présente, l'exposition à des niveaux « sûrs » de certains pesticides peut entraîner des maladies. Et une étude portant sur plus de 17,000 frères jumeaux a montré que pour la maladie de Parkinson typique d'apparition tardive, les facteurs environnementaux sont plus importants que la génétique.
Le rôle des produits chimiques neurotoxiques
Exposure to pesticides and other neurotoxic chemicals significantly increases the risk of Parkinson’s disease. The US Environmental Protection Agency (EPA) is lagging behind when it comes to banning chemicals that have been shown to cause Parkinson’s and other diseases. For example, 32 countries, including China, have banned paraquat, a pesticide that increases the risk of Parkinson’s by 150%. The Netherlands banned paraquat, trichloroethylene (a solvent), and other pesticides linked to Parkinson’s and their rates of Parkinson’s declined sharply. The United States needs to do the same, but financial profit is clearly taking precedence over public health and safety.
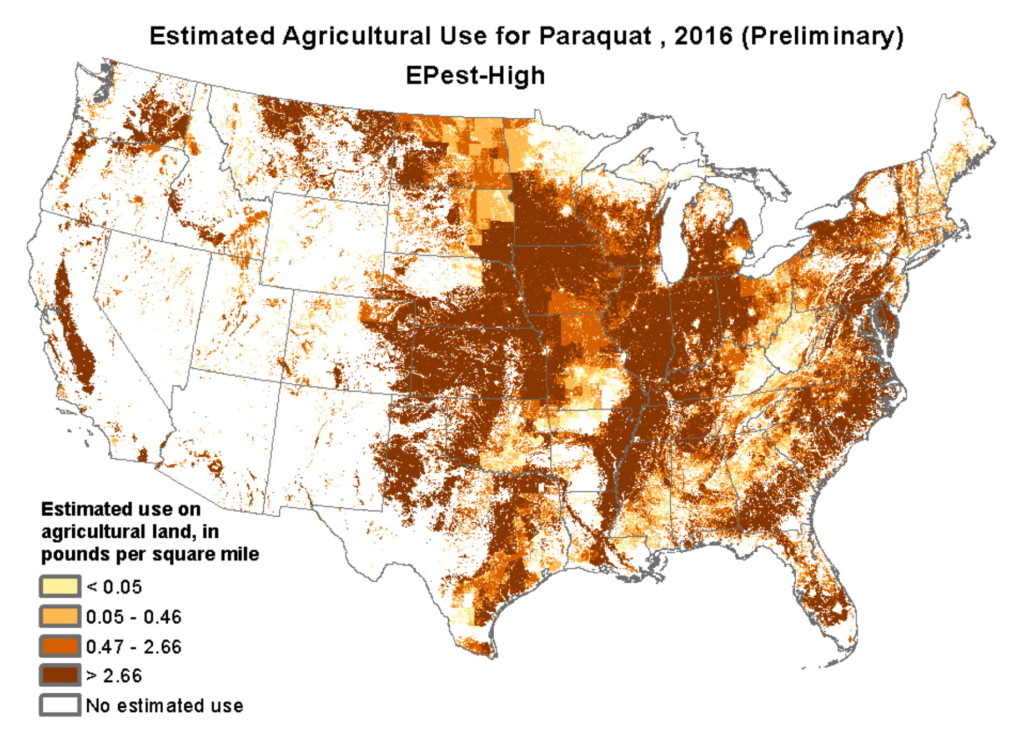
Au lieu d'être interdite, l'utilisation du paraquat sur États-Unis terres agricoles a doublé au cours de la dernière décennie. Des études en laboratoire ont montré que le paraquat tue les neurones dopaminergiques et qu'il peut également provoquer la cécité et des hémorragies internes. Avaler une cuillerée à thé est fatal, et parce qu'il est si facilement disponible, les gens l'utilisent pour se suicider. En agriculture, le paraquat est principalement utilisé dans la culture du maïs, du soja, du blé, du coton et du raisin. La carte ci-dessous montre l'utilisation estimée du paraquat dans le États-Unis.
L'utilisation de paraquat et d'autres pesticides est la raison pour laquelle les zones agricoles ont les taux les plus élevés de maladie de Parkinson. Les agriculteurs ont un risque 170 % plus élevé que les non-agriculteurs de développer la maladie de Parkinson, et plus ils sont exposés longtemps aux pesticides, plus leur risque est élevé. Et le simple fait de vivre dans des zones agricoles augmente le risque de maladie de Parkinson car l'air, les eaux souterraines et l'eau des puits peuvent être pollués par des pesticides toxiques.
Le solvant industriel trichloroéthylène (TCE) contribue également à la maladie de Parkinson, ainsi qu'au cancer. Les personnes exposées au TCE au travail sont six fois plus susceptibles de développer la maladie de Parkinson. Jusqu'à 1977, le TCE était utilisé comme anesthésique chirurgical. Aujourd'hui, il est toujours utilisé pour dégraisser le métal, dans le nettoyage à sec et dans les produits ménagers tels que les décapants pour peinture, les détachants, la colle, les nettoyants pour tapis et les nettoyants pour pistolets. Même si le TCE est connu pour être toxique depuis les 1930, les États-Unis utilisent environ 250 millions de livres de produit chimique chaque année.
Dans des expériences sur des rats, le TCE tue les neurones dopaminergiques de la substance noire. Une étude a révélé que 68 % des travailleurs d'une petite usine industrielle du Kentucky présentaient des symptômes de la maladie de Parkinson, et ceux qui étaient le plus exposés au TCE étaient les plus susceptibles d'avoir des symptômes. Le TCE peut être inhalé par l'air pollué, ingéré par l'eau contaminée et absorbé par la peau. L'EPA a déclaré que le TCE est "cancérogène pour l'homme par toutes les voies d'exposition" et que l'exposition chronique est dommageable pour le cerveau et le système nerveux.
Frighteningly, up to 30% of the US drinking water supply is contaminated with TCE. Almost half of Superfund sites (designated toxic waste dumping sites) are contaminated with TCE, and local residents have higher rates of Parkinson’s disease and cancer.
Il existe également d'autres produits chimiques liés à la maladie de Parkinson, notamment l'agent orange, un herbicide utilisé pendant la guerre du Vietnam pour tuer la végétation afin que les avions de chasse puissent voir l'ennemi au sol en contrebas. Le solvant de nettoyage à sec perchloroéthylène (PCE), l'insecticide DDT et le pesticide heptachlore en sont d'autres. Il y en a peut-être encore d'autres qui n'ont pas été identifiés.
L'utilisation de produits chimiques toxiques dans l'agriculture, l'industrie et certains produits est l'une des raisons pour lesquelles les hommes sont diagnostiqués avec la maladie de Parkinson 40 % plus souvent que les femmes. Dans le États-Unis, 75 % des agriculteurs sont des hommes, ainsi que 80 % des travailleurs du métal et du plastique, 90 % des travailleurs de la chimie, 91 % des peintres, 96 % des soudeurs et 97 % des travailleurs de la lutte antiparasitaire.
Pesticides and other toxic chemicals kill dopaminergic neurons in a number of ways. They can damage the cytoskeleton, mitochondra, or myelin sheath (protective coating); cause oxidative stress or an overload of calcium; interfere with neurotransmission; or inhibit ALDH enzymes that detoxify the dopamine metabolite DOPAL.
While exposure to certain toxic chemicals increases the risk of developing Parkinson’s, exposure alone usually does not mean that a person will definitely get the disease. Just as at least 75% of heavy smokers will not get lung cancer, most people who are exposed to pesticides and other neurotoxic chemicals will not get Parkinson’s. It’s when pesticide exposure and other risk factors, like genetics and the lifestyle factors I’ll describe next, come together that risk increases dramatically.
Le rôle du traumatisme crânien
In recent years, the long term negative effects of repetitive head injuries, like those suffered by professional football players, has become widely recognized. Football players are more likely to suffer from Alzheimer’s disease, amyotrophic lateral sclerosis (ALS; Lou Gehrig’s disease), chronic traumatic encephalopathy (CTE), and Parkinson’s disease. In a 2017 study of 111 former NFL players, two-thirds of them had parkinsonian symptoms including tremor, slow movement, difficulty walking, and a tendency to fall.
Les lésions cérébrales traumatiques sont également courantes chez les vétérans militaires et les athlètes comme les boxeurs et les joueurs de hockey sur glace, de football et de crosse. Une seule blessure à la tête entraînant une perte de conscience triple le risque de maladie de Parkinson, et des blessures répétées augmentent davantage le risque.
Un traumatisme crânien peut déclencher l'agglutination des protéines, formant les corps de Lewy de la maladie de Parkinson et les plaques amyloïdes de la maladie d'Alzheimer. Ces amas de protéines peuvent faire éclater les membranes cellulaires, entraînant la mort des neurones. Les scientifiques suggèrent que davantage de recherches sont nécessaires pour déterminer si la forme de la maladie de Parkinson liée à un traumatisme crânien est la même que celle qui est présente chez les personnes qui n'ont aucun antécédent de traumatisme crânien.
Le rôle du manque d'exercice
Given that movement is affected in Parkinson’s disease, it makes sense that regular exercise would help to prevent it as well as slow the progression. In a study of more than 7,300 male veterans, those with the lowest level of physical fitness had a 316% higher risk of developing Parkinson’s than those with the highest level of physical fitness.
Comme d'autres recherches portant sur la génétique, les pesticides et les traumatismes crâniens, cette étude a révélé un risque accru de développer la maladie de Parkinson lorsque plusieurs facteurs de risque étaient impliqués. Les chercheurs ont examiné l'âge, la condition physique et le tabagisme (qui, étonnamment, diminue le risque). Ils ont constaté que les personnes présentant deux des facteurs de risque étaient 3.7 fois plus susceptibles de développer la maladie de Parkinson, et les personnes présentant les trois facteurs de risque étaient 7.8 fois plus susceptibles.
Reduced physical activity is likely an early symptom of Parkinson’s disease; as movement becomes more difficult, people are less likely to move. Neuroscientists at the University of Texas in Austin did an interesting study to explore whether or not a reduction in physical activity also speeds up the degeneration of dopaminergic neurons. By restricting the movement of rats, they were able to show that the restriction of movement led to severe and chronic loss of dopaminergic neurons and impaired motor function. Neurons that aren’t used tend to wither away and die—this is called neural pruning. When it comes to movement, the principle of “use it or lose it” applies not only to our muscles, but to the health of our brain as well.
On the flip side, when we use certain parts of our brain a lot, it stimulates neuroplasticity and neurogenesis in those areas. And exercise stimulates neuroplasticity and neurogenesis throughout the brain by triggering the release of neurotrophic factors, which encourage synaptic plasticity, promote the initial growth and development of neurons, support neuronal survival, and even regrow damaged neurons. Not only does regular exercise help to prevent Parkinson’s, but it also improves motor symptoms and slows progression of the disease. Research shows how exercise prevents the loss of, protects, and actually restores dopaminergic neurons in Parkinson’s disease; I’ll discuss this in detail in next week’s post.
Le rôle de l'alimentation et de la dysbiose intestinale
L'alimentation et la santé intestinale contribuent à la maladie de Parkinson de plusieurs façons. Je commencerai par certaines des preuves accablantes des avantages d'un régime à base de plantes et des effets nocifs d'un régime riche en protéines animales.
A 2007 study of 130,000 people found that a Mediterranean-style diet (high in fruit, vegetables, and fish) was associated with a 22% reduced risk of Parkinson’s when compared with the Western-style diet (high in red meat, processed and fried food, refined grains, sugar, and high-fat dairy products). The authors of Ending Parkinson’s Disease suggest that one way a Mediterranean-style diet may be protective is that it’s high in antioxidants, which may reduce the development of Lewy bodies. Antioxidants also prevent damage to mitochondria, which are damaged in Parkinson’s disease.
Along those same lines, research shows that high consumption of dairy products is associated with an 80% increased risk of Parkinson’s in men and a 30% increased risk in women.
And in 2011, a study of Parkinson’s patients showed significant improvement of motor symptoms after just four weeks on a plant-based diet, when compared to a control group on an omnivorous diet. The explanation for the quick results may be explained by the connection between animal protein and levodopa.
A fascinating study showed how consumption of animal protein elevates levels of large neutral amino acids (LNAAs), which compete with levodopa for transport across the blood-brain barrier. On regular and high-protein diets, patients had parkinsonian motor symptoms despite having elevated levels of levodopa in their blood from medication. When patients were put on a low-protein diet, their LNAA levels dropped, and they were relieved of their motor symptoms.
Other research shows that levodopa levels and motor symptoms are both improved on a high-fiber diet. If you have three minutes, watch this video by Dr. Michael Greger about diet and Parkinson’s disease.
Liée au régime alimentaire et à d'autres facteurs, la dysbiose intestinale est souvent présente dans la maladie de Parkinson. La dysbiose intestinale est un déséquilibre du microbiome intestinal, la collection de micro-organismes, bactéries, virus, protozoaires et champignons dans le tube digestif.
Gut dysbiosis is associated with many health issues, from neurodegenerative diseases to digestive problems, autoimmune conditions, allergies, anxiety and depression, skin conditions, obesity, and diabetes. A thorough 2019 review discusses the role of gut dysbiosis, inflammation, and leaky gut in Parkinson’s disease, and the potential role of probiotics and fecal transplantation in treatment.
A 2016 study showed that Parkinson’s symptoms are actually transmissible through fecal matter. Researchers gave mice fecal material from healthy human subjects, and their motor function was unchanged. But when the mice were given fecal material from people with Parkinson’s, their motor function worsened. Researchers suggest the possibility that fecal transplants may at some point be used to treat Parkinson’s disease.
Alors que les greffes fécales deviennent de plus en plus courantes, et à juste titre, elles ne sont peut-être pas toujours nécessaires. Consommer un régime alimentaire complet à base de plantes, ainsi que des pré- et probiotiques, ainsi qu'éviter les antibiotiques, peut grandement contribuer à équilibrer vos bactéries intestinales. Le stress, le manque d'exercice et le manque de sommeil ont également des effets négatifs sur le microbiome intestinal.
Also related to diet and other factors, constipation is a very common early symptom of Parkinson’s. Men with constipation are 2.7 times more likely to develop Parkinson’s than men without. As I mentioned earlier, it’s believed that constipation occurs early on in the disease process because of the development of Lewy bodies in the enteric nervous system. It has also been suggested that constipation can contribute to gut dysbiosis because food stays in the digestive tract longer than it should. Whether or not you have Parkinson’s, the simplest ways to get things moving are consuming lots of fruit, vegetables, whole grains, and legumes; staying hydrated; and exercising regularly.
Le rôle du stress chronique
Le stress chronique augmente le risque de pratiquement toutes les maladies chroniques, y compris le cancer, les maladies cardiaques, les maladies auto-immunes et les maladies neurodégénératives. Le stress joue un rôle dans la maladie de Parkinson de trois manières :
1. La dépression est un symptôme précoce de la maladie de Parkinson, et les chercheurs suggèrent que le stress chronique précédant l'apparition des symptômes moteurs pourrait également être un symptôme précoce.
2. La maladie de Parkinson est très stressante, car elle limite les fonctions et a un mauvais pronostic.
3. Le stress chronique contribue à l'apparition et à l'aggravation de la maladie de Parkinson en augmentant la neuroinflammation et la neurodégénérescence.
The third way is becoming more widely researched, as stress is finally being recognized as a risk factor for Parkinson’s. A 2017 study found that mice subjected to chronic stress experience loss of dopaminergic neurons in the substantia nigra—the same neurons lost in humans with Parkinson’s. And a 2014 study found that the inflammatory response in stressed rats led to a higher rate of death of dopaminergic neurons in the substantia nigra. This confirmed previous research showing that stress and elevated glucocorticoid levels lead to death of these dopaminergic neurons.
The stress response is regulated by the hypothalamic-pituitary-adrenal axis (HPA axis), the functional connection between the hypothalamus, pituitary gland, and adrenal glands. When we perceive stress, our hypothalamus releases corticotropin-releasing hormone (CRH), which in turn stimulates our pituitary gland to release adrenocorticotrophic hormone (ACTH). ACTH then stimulates our adrenal cortex to release cortisol and other corticoid hormones, which act on nearly every tissue in our body. The HPA axis is the mechanism by which stress and emotions affect our health. Chronic stress can cause dysregulation of the neuroendocrine and immune systems, leading to neuroinflammation, oxidative stress, and loss of dopaminergic neurons.
A study of 330 people showed the link between stress and risk of Parkinson’s; risk increased significantly with the number of stressful life events that people had experienced. A population-based study of over 2.5 million residents of Sweden found that job-related stress was associated with an increased risk of Parkinson’s disease. And stress-related personality traits, like being anxious, pessimistic, and neurotic, are associated with an increased risk of Parkinson’s.
Stress level also predicts worse disease progression. Acute stress worsens motor symptoms of Parkinson’s, including bradykinesia, freezing, and tremor. In a study of 4,155 Parkinson’s patients, stress predicted mortality and worsening mobility.
Vers l'amélioration et la récupération
Bien qu'il n'existe aucun remède pharmaceutique ou chirurgical pour la maladie de Parkinson, il y a de l'espoir. Les scientifiques sont optimistes quant aux approches de traitement non invasives qui stimulent la neurogenèse et mobilisent les cellules souches neurales endogènes - celles qui sont naturellement produites dans le cerveau - pour survivre, migrer et se différencier en neurones dopaminergiques dans la substantia nigra. Mais vous n'avez pas à attendre que ces traitements soient approuvés.
Les chercheurs conviennent que l'exercice, en particulier l'exercice vigoureux, devrait être prescrit aux patients atteints de la maladie de Parkinson dans le cadre du traitement. Ils notent qu'il n'existe actuellement aucun traitement pharmacologique capable de modifier ou de ralentir la maladie ou de protéger les neurones dopaminergiques comme le fait l'exercice. Pour les patients atteints de la maladie de Parkinson, l'exercice fait ce que les médicaments ne peuvent pas faire.
Most exciting of all, there are Parkinson’s patients who report significantly improving their motor symptoms and in some cases, eliminating them completely. For most of them, some form of mindfulness or stress reduction played a large role in their recovery. I’ll tell their stories, discuss neurogenesis as it applies to Parkinson’s, and explain how exercise and stress reduction can heal the damage done to the brain by Parkinson’s disease in next week’s post.
Lecture recommandée:
The Pain Relief Secret: How to Retrain Your Nervous System, Heal Your Body, and Overcome Chronic Pain by Sarah Warren, CSE
Somatics: Reawakening the Mind’s Control of Movement, Flexibility and Health by Thomas Hanna